编者按:2016年4月13日,第51届欧洲肝脏研究协会(EASL)年会正式开幕的前一天,是大会组委会设置的继续教育课程日。今年的课程将聚焦的病种锁定为肝癌,分别从肝癌的发病机制、筛查诊断、个体化治疗以及其他良性肿瘤的诊治方面设置了综合性的专题。其中,来自英国伦敦大学学院癌症研究所的著名肝癌学者Tim Meyer教授针对近年来肝癌治疗中涌现的全身治疗药物进行了全面深入的总结和剖析。
索拉非尼——目前的标准方案
索拉非尼是一种多激酶抑制剂,通过靶向作用于肿瘤细胞及肿瘤血管上的丝氨酸-苏氨酸激酶及受体酪氨酸激酶,包括Raf-1、B-Raf、血管内皮生长因子受体(VEDFR)-1、VEDFR-2、VEDFR -3、血小板源性生长因子受体-β(PDGFR-β)等,从而发挥抗血管生成和抗肿瘤细胞增殖的双重作用。到目前为止,它仍然是唯一一个被批准用于肝细胞肝癌(HCC)的全身化疗药物。
索拉非尼在两项随机临床试验中证实,与安慰剂相比,索拉非尼平均可延长患者2~3个月的总体生存(OS)。其中,最大规模的临床研究SHARP试验主要由北美和欧洲发起,共招募了602例患者。在这些患者中,绝大多数(95%)的肝功能为Child- Pugh A级,ECOG活动状态评分尚好(PS)< 2(92%)。这些患者按1:1的比例随机分配至索拉非尼治疗组和安慰剂组。结果显示,索拉非尼组较对照组的中位OS更长(10.7个月 vs. 7.9个月,P<0.001)。最常见的不良反应为疲劳、腹泻和手足皮肤反应。另一项研究由亚洲发起,患者来自中国、韩国和台湾地区,按2:1的比例随机分为索拉非尼治疗组(n=150)和安慰剂治疗组(n=76)。结果与SHARP试验类似,索拉非尼组的中位OS较对照组延长(6.5个月 vs. 4.2个月,P=0.014)。
凭借上述两项研究结果,2007年美国FDA和欧洲EMA批准索拉非尼用于HCC的治疗,该方法也得到了国际指南的推荐。
随后,一项大型随机对照的全球研究评价了索拉非尼作为RFA或外科切除术辅助治疗的疗效。然而,索拉非尼并没有显著提高患者的中位无复发生存时间。此外,在索拉非尼联合TACE治疗的研究中,虽然其安全性尚可,但是目前还没有数据证实两者联合优于单用TACE治疗。
哪些患者能从索拉非尼中获益?
自从索拉非尼被批准使用以来,已有大量的关于预测索拉非尼疗效的标志物的研究。对于SHARP研究数据的亚组分析发现,索拉非尼可延长各亚组人群的生存,不论疾病的病因、肿瘤负担、体能状态和肿瘤分期如何。不过,与其他病因相比,丙型肝炎患者受益更大。相同结论也在一项包括其他三项临床试验的Meta分析中得到了证实。
此外,研究证实促血管生成素-2和VEGF浓度与索拉非尼治疗的预后相关,高可溶性c-KIT、低肝细胞生长因子(HGF)浓度与索拉非尼疗效有关,但仍需要更多的前瞻性研究结果来证实该结论。
细胞毒性化疗
在索拉非尼被批准前,细胞毒性化疗已被广泛用于HCC的治疗,目前在很多医疗中心尤其是在亚洲仍是HCC的标准治疗。然而,细胞毒性化疗的益处仍不确定,原因是没有充分的数据对化疗与安慰剂进行对比。
有关阿霉素治疗的一项随机对照临床试验发现,其中位OS范围为5.6~7.4个月,影像学应答率介于3%~10%之间。一项中国的临床试验发现,奥沙利铂联合氟尿嘧啶(FOLFOX 4)是唯一一个优于阿霉素的方案,该研究发现阿霉素的应答率为2.7%,中位OS为5.0个月,而FOFLOX 4方案的应答率和中位OS分别为8.2%和6.4个月(P=0.07)。
一项II期临床试验比较了索拉非尼联合阿霉素与单用阿霉素的疗效。有趣的是,索拉非尼联合阿霉素的中位OS显著优于阿霉素单药治疗(13.7个月 vs. 6.5个月)。而不幸的是,联合组的结果并不优于索拉非尼单药治疗,此项试验最近也由于无效而终止。目前还没有足够的证据支持使用细胞毒性药物来对HCC进行化疗。
靶向治疗——“惨痛”的失败与原因
索拉非尼被批准应用之后的许多一线和二线的随机临床试验报道了令人失望的结果。
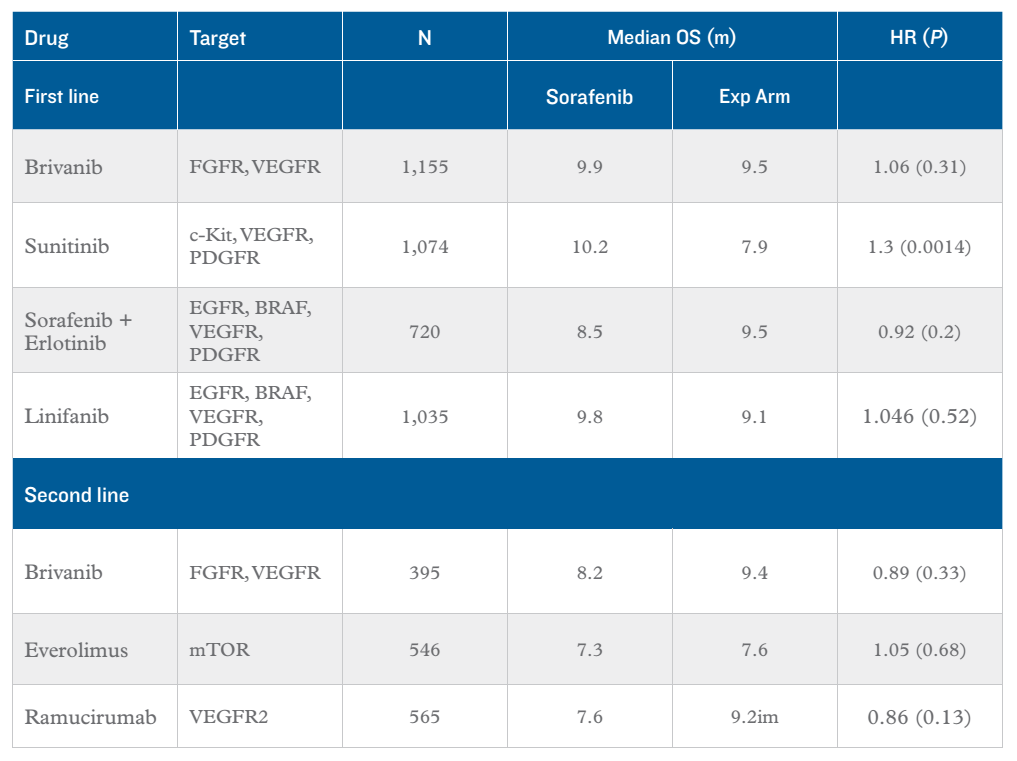
一线方案:在关于一线靶向药物治疗的III期临床研究中,新型靶向治疗药物brivanib、sunitinib、linifinib和erlotinib分别与索拉非尼进行了比较(见表1)。然而,令人失望的是,所有研究均未发现任何一种新型药物可优于索拉非尼。失败的原因可能是多方面的:首先,这些研究并未证实药物的优越性,或研究本身缺乏说服力。由于试验药物如brivanib、sunitinib和linifinib均是抗血管生成的多激酶抑制剂,与索拉非尼有许多共同的靶点,可以预测这些药物最多也只能比索拉非尼稍微好一点。第二,对于sunitinib来说,已证实肝功损害患者对其耐受性差,可增加治疗相关死亡,且生存率低于索拉非尼。第三,早期临床试验未能进行到III期。对于EGFR抑制剂erlotinib来说,尚没有令人信服的II期试验足以支撑其进一步的应用,无论是单用还是与索拉非尼联用均是如此。
二线方案:由于缺乏标准方案,在索拉非尼之后的很多靶向药物的二线治疗临床研究使用安慰剂作为对照(见表1)。然而,这些试验却意外地发现了对照组的长期生存。这可能是由于brivanib并不优于安慰剂造成的。与对照组相比,VEGFR2单克隆抗体ramucirumab和小分子mTOR抑制剂everolimus同样不能改善患者的生存,虽然亚组分析提示AFP高水平患者可能从ramucirumab获益。
表1. 索拉非尼相关III期临床试验汇总
虽然与索拉非尼相比,替代的抗血管生成药物在改善患者生存方面没有提高,但是仍有大量的抗血管生成药物正在进行或已完成在HCC中的评估,包括nintedanib、lenvatinib、regorafenib、bevacizumab和axitinib。此外,一些新的治疗靶点也正在开发中。
纵观肿瘤研究进展,科学家们正致力于通过寻找相关分子特征或其他可能的预测指标,从而实现对患者的分层治疗。该策略的宗旨是寻找到适合某一治疗的特定人群,实现精准化治疗,同时避免不必要经济负担和毒副作用。
有关患者分层的研究,人们在一些最初的临床病例发现了一些线索。例如,在ramucirumab作为二线治疗的III期临床试验中,虽然结果为阴性,但在亚组分析中提示,AFP>400 μg/L的患者可从中获益。目前针对AFP>400 μg/L的HCC患者的第二个III期临床试验正在进行。MET抑制剂tivantinib也有类似的现象,在一项应用索拉非尼仍有疾病进展的II期随机临床试验中发现,对于免疫组化证实“MET高”的患者来说,其无疾病进展生存时间更长。因此,目前针对MET高的选择性患者正在接受相关的III期临床研究。
Ras通路是不同种类肿瘤治疗的共同靶点。尽管HCC中Ras的突变率很低只有5.8%,但在一项关于MEK抑制剂refametinib的非选择性患者临床试验中,研究发现3/4存在Ras突变的患者出现了部分应答。一项联合应用索拉非尼和refametinib的单臂II期临床试验近期已完成RAS突变患者的招募。
虽然目前已有明确的理由支持对患者进行分层,但其中仍存在重大挑战:首先,需要完全清楚药物作用的关键机制,但在某些多激酶抑制剂中尚未明确;第二,招募有罕见突变的大量患者将延缓药物的开发,增加筛选成本;第三,必须有可靠的、符合成本效益的、且在临床中易于实施常规检测的相关生物学标志物;最后,肿瘤的异质性越来越得到人们的认识,这是许多靶向治疗耐药性出现的基础,克服肿瘤异质性将是我们面临的一个主要挑战。
免疫治疗
经过近几十年来的大量研究,肿瘤免疫治疗已经成为了一门新兴学科。但是从历史上看,肿瘤免疫治疗的重点还是利用肿瘤疫苗的方法来刺激免疫系统。近期有学者通过调节肿瘤免疫微环境的手段,研发出了可阻断免疫抑制信号的药物,产生细胞介导的抗肿瘤反应。所谓的检查点抑制剂,可阻断负性调控分子如细胞毒性T淋巴细胞相关蛋白-4(CTLA-4)、程序性细胞死亡蛋白-1(PD-1)及其配体PD-L1,使黑素瘤和肺癌的治疗产生了革命性的改变。
从最初应用CTLA-4抑制剂tremelimumab治疗HCC的报告发现安全性好,影像学应答率达18%,到PD-1抑制剂nivolumab进行的I期临床试验约20%的应答率,这些研究结果都向我们揭示了肿瘤免疫治疗具有非常广阔的应用前景。但是我们必须清醒地看到,大多数患者并未获益,且需要具有预测价值的生物标志物。肿瘤疫苗、过继性细胞治疗和基因治疗等其他免疫治疗的方法均在研发中,其在HCC中的有效性也有待进一步证实。