首都医科大学附属北京地坛医院肝病中心
邓优 谢雯
编者按
如何实现大多数慢性HBV感染的功能性治愈,是当前病毒性肝炎临床治疗面临的最大难题。在第31届APASL年会上,来自美国费城威斯塔研究所的H C Ertl教授报告了一种用于慢性HBV患者潜在功能性治愈疗法的新型治疗性疫苗——VRON-0200的临床前研究,初步分析了该药的免疫原性和疗效。本刊特邀首都医科大学附属北京地坛医院肝病中心谢雯教授针对该项研究进行了深度点评。
VRON-0200(gD-HBV2)是一种基于黑猩猩腺病毒(AdC)载体的新型治疗性HBV疫苗,表达病毒聚合酶(pol)的保守和高度免疫原性区域和核心抗原融合到单纯疱疹病毒糖蛋白D(gD),是CD8+T细胞活化的检查点修饰剂。Ertl教授报告了来自VRON-0200研究的临床前数据。
该研究在 C57Bl/6和BALB/c小鼠的血液和脾细胞中评估免疫原性。在首次静脉注射的 C57Bl/6小鼠中测试功效。 随着AAV8-1.3HBV载体剂量的增加,在4周后用表达gD内pol 的N末端序列的疫苗(gDPolN)、pol和有或没有gD的核心(gD-HBV2、HBV2)进行疫苗接种。未接种疫苗的小鼠作为对照。免疫接种后检测淋巴细胞产生IFN-g疫苗插入物特异性CD8+T细胞的频率和表位特异性,检测血清的HBV DNA水平。
疫苗接种诱导CD8+T细胞对疫苗gD的增强反应。 在注射了109个 AAV8-1.3HBV病毒基因组拷贝(vg)的小鼠中,接种gD-HBV2可使HBV DNA持续下降3 log10,而幼稚小鼠则显示约0.5 log10增加(见图1); 将AAV剂量增加到1010和1011 vg,HBV DNA水平分别降低了2 log10和1 log10,同时伴随着循环HBsAg的降低。循环疫苗插入特异性CD8+T细胞的频率与HBV病毒载量呈负相关。
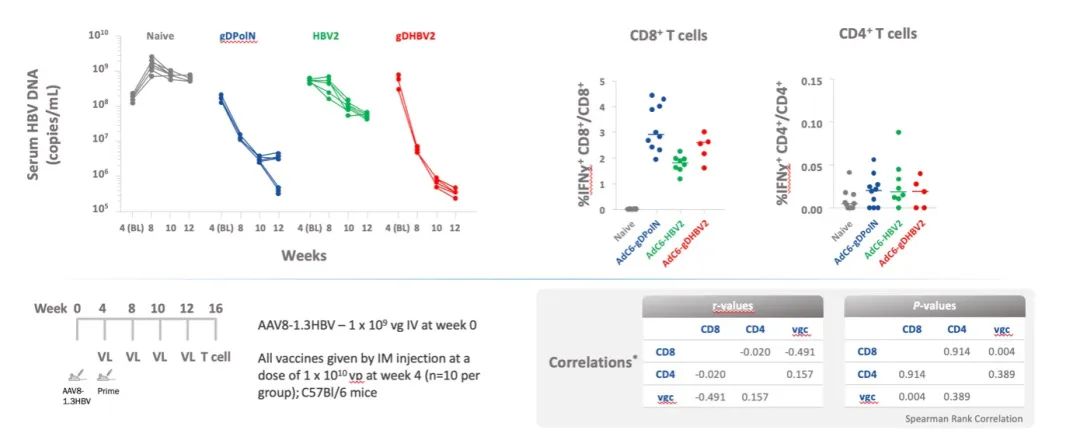
图1. 接种gD-HBV2可使HBV DNA水平变化
(图表引自大会摘要)
以上临床前研究表明,VRON-0200在具有持续抗病毒活性的小鼠中诱导有效且广泛的CD8+T细胞反应。VRON-0200的国际Ib期研究正在进行中。
专家点评
截至到2022年1月,靶向人体免疫系统来攻击HBV病毒的乙型肝炎治疗性疫苗在研项目已有20余种,VRON-0200是其中之一,已完成临床前研究,正在进行国际Ib期研究。
目前阶段来看,治疗性疫苗研究方兴未艾,获得性免疫在急性HBV感染消退中具有关键性作用,使用治疗性疫苗增强获得性免疫是目前最有效的治疗方法,但是对患者循环中的病毒抗原水平进行定量是目前研究工作中的瓶颈。
由于适应性免疫(抗体和T细胞)在急性HBV感染中的核心作用,既往研究在CHB患者中增强这种反应进行了很多努力。增强适应性免疫的最合理方法是给予HBV治疗性疫苗接种。
疫苗接种的主要障碍是循环中病毒抗原的数量。血浆HBsAg为5000 IU/ml的CHB患者约等于25 μ g/mL的HBsAg,人体约5000 mL的总血容量,计算HBsAg总负荷为68 mg。因此,疫苗中递送的HBV抗原与自然循环抗原数量匹配,达到充分的免疫识别是当务之急。
迄今为止,已经有许多治疗性疫苗试验,包括使用重组抗原或基于DNA的疫苗、基于肽的疫苗或基于载体的递送酵母疫苗等。然而,这些都没有显示出对HBV复制或循环HBsAg的影响。早期疫苗研究没有联合NA治疗,不清楚是否可以改善T细胞反应,以及对HBsAg水平的影响。在少数测量T细胞和B细胞反应的研究中,体外检测HBV特异性T细胞是罕见的,并且需要在体外扩增来测量疫苗接种的影响, 这表明抗原递送和免疫刺激力度不够。
新的治疗性疫苗包括基于病毒载体的疫苗,可有效诱导CD8+T细胞,这对于病毒清除至关重要。病毒载体在诱导T细胞反应方面具有优势,因为它们在注射部位 “感染” 细胞并诱导炎症反应。“感染” 在细胞质内表达疫苗抗原,将HBV抗原呈递到主要组织相容性复合物(MHC)I类和II类途径中,刺激CD8+和CD4+T细胞活化,协调辅助性T细胞1型细胞分泌细胞因子。黑猩猩腺病毒载体,改良的牛痘安卡拉(MVA)和沙粒病毒载体将很快在临床试验中进行研究。腺病毒载体现已被广泛测试,并在人类中具有高度免疫原性。
除了新的病毒载体疫苗,通过添加佐剂诱导IL-12表达和通过电穿孔递送,已经改善了基于DNA的疫苗接种的递送。基于肽的疫苗也已使用新的化学方法更新了HepTcell疫苗,通过在注射部位更持久的沉积来增加肽的可用性,从而提高免疫原性。
总体而言,新的疫苗策略,与减少HBV复制的DAA相结合,将显著增加HBV特异性T细胞和B细胞反应(图2-3)。重要的是,未来的疫苗研究必须定量测量免疫反应,以了解T细胞和B细胞的免疫诱导与HBV抗原载量的关系。疫苗抗原和不同HBV基因型之间的不匹配可能会降低功效,但是可能会有足够的交叉反应来识别病毒。
图2. 直接作用抗病毒药物简要机制
图3. 各免疫调节剂简要作用机制
其他问题包括循环抗原的数量是否会影响功效,以及疫苗诱导的T细胞是否会聚集在肝脏。免疫系统持续高水平暴露于HBsAg的负面影响,在老年人中显示出HBs特异性T细胞的减少,但HBcAg和HBV聚合酶特异性T细胞被保留,提示在疫苗研制中应考虑这些因素。HBV特异性T细胞可以表达抑制性受体, 并显示出代谢功能障碍和衰竭的表观遗传表现。然而,受限制的T细胞功能可以通过诱导增殖来克服,通过减少HBV抗原来促进。
从现有临床前研究及临床研究数据来看,单纯的HBV治疗性疫苗(包括其他治疗药物)实现HBV临床治愈难度极大。因此新药联合治疗的探索明显加速,包括新药与新药联合、新药与现有药物的联合。许多新药单药在I期或II期研究中未达到主要疗效目标,研究者及研发企业开始不同联合治疗方案的积极探索。这也将是未来乙肝全面临床治愈的必要策略。
参考文献:
Fung S, Choi HSJ, Gehring A, Janssen HLA. Getting to HBV cure: the promising paths forward. Hepatology. 2022;10.1002/hep.32314. doi:10.1002/hep.32314.